IKATAN DAN UNSUR KIMIA
PENGERTIAN IKATAN KIMIA



3. Ikatan Kovalen

Ketika pertukaran elektron valensi terjadi antara atom-atom, ikatan kovalen terbentuk. Sebuah ikatan kovalen polar terbentuk ketika dua atom tidak berbagi elektron valensi sama.

Ikatan logam merupakan ikatan kimia yang terjadi karena adanya gaya tarik-menarik yang kuat antara ion positif dari logam terhadap elektron-elektron valensi yang bergerak bebas. Ikatan logam tersebut menyebabkan sifat-sifat logam diantaranya adalah pada suhu kamar rata-rata berwujud padat terkecuali logam Hg, keras namun dapat ditempa, menjadi konduktor atau penghantar panas yang baik, memiliki titik didih dan titik leleh yang tinggi serta wujud fisiknya yang mengkilap.

Karena kation dan anion unsur yang berbeda dalam senyawa ion diikat dengan interaksi elektrostatik, jarak ikatan adalah jumlah jari-jari ionik yang diberikan untuk kation dan anion.
Jari-jari ionik standar satu spesies ditetapkan terlebih dahulu dan kemudian dikurangkan dari jarak antar ion untuk menentukan jari-jari ion partnernya. Sebagai standar, jari-jari ion O2- dalam sejumlah oksida ditetapkan sebesar 140 pm (1 pm = 10-12 m).

Energi potensial Coulomb total antar ion dalam senyawa ionik yang terdiri atas ion A dan B adalah penjumlahan energi potensial Coulomb interaksi ion individual, Vab. Karena lokasi ion-ion dalam kisi kristal ditentukan oleh tipe struktur, potensial Coulomb total antar ion dihitung dengan menentukan jarak antar ion d. A adalah tetapan Madelung yang khas untuk tiap struktur kristal. NA adalah tetapan Avogadro dan zA dan zB adalah muatan listrik kation dan anion. Interaksi elektrostatik antara ion-ion yang bersentuhan merupakan yang terkuat, dan tetapan Madelung biasanya menjadi lebih besar bila bilangan koordinasinya meningkat. Sebab muatan listrik mempunyai tanda yang berlawanan, potensialnya menjadi negatif, menunjukkan penstabilan yang menyertai pembentukan kisi kristal dari ion-ion fasa gas yang terdispersi baik. Walaupun potensial listrik terendah biasanya menghasilkan struktur paling stabil, namun ini tidak selalu benar sebab ada interaksi lain yang harus dipertimbangkan. Faktor terbesar selanjutnya yang berkontribusi pada entalpi kisi adalah gaya van der Waals, dan gaya dispersi atau interaksi London. Interaksi ini bersifat tarikan antara dipol listrik, yang berbanding terbalik dengan pangkat 6 jarak antar ion. Gaya van der Waals nilainya sangat kecil.
Struktur Kristal Logam









Energi Ionisasi adalah energi eksitasi dari HOMO dan afinitas elektron adalah energi penambahan elektron ke LUMO.Sehingga ke-elektronegatifan adalah rata-arat energi HOMO dan LUMO.
Molekul Orbital
Fungsi gelombang elektron dalam suatu atom disebut orbital atom. Karena kebolehjadian menemukan elektron dalam orbital molekul sebanding dengan kuadrat fungsi gelombang dan peta elektron nampak seperti fungsi gelombang
Suatu gelombang fungsi mempunyai daerah beramplitudo positif dan negatif yang disebut cuping (lobes).
Syarat pembentukan orbital :
1) Cuping orbital atom penyusunannya cocok untuk tumpang tindih
2) Tanda positif atau negatif cuping yang bertumpang tindih sama
3) Tingkat energi orbital-orbital atomnya dekat



- Ikatan kimia adalah sebuah proses fisika yang bertanggung jawab dalam interaksi gaya tarik menarik antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik menjadi stabil. Ikatan kimia terbentuk karena unsur-unsur cenderung membentuk struktur elektron stabil. Walter Kossel dan Gilbert Lewis pada tahun 1916 menyatakan bahwa terdapat hubungan antara stabilnya gas mulia dengan cara atom berikatan.
Dalam ikatan kimia, cara yang diambil unsur supaya dapat mengikuti gas mulia, yaitu:
- melepas atau menerima elektron;
- pemakaian bersama pasangan elektron.
Jenis-jenis ikatan kimia ada 4 yaitu :
1. Ikatan Ionik

Ikatan ion adalah interaksi elektrostatik antara atom-atom yang memiliki perbedaan elektronegatif besar. Ikatan ion terbentuk ketika sebuah atom menerima atau menyumbangkan satu atau lebih elektron valensi pada atom lain. Ion negatif (anion) dan ion positif (kation) yang terbentuk selama ikatan ionik kimia.
2. Ikatan Hidrogen

Ikatan kimia jenis ikatan hidrogen merupakan ikatan yang terbentuk antara unsur H dengan atom F,O dan N. Suatu zat yang memiliki ikatan hidrogen yang lebih banyak biasanya akan lebih cepat mendidih saat dipanaskan. Secara umum ikatan hidrogen terbagi ke dalam dua jenis yakni ikatan hidrogen intra molekuler dan ikatan hidrogen ekstra molekuler. Ikatan hidrogen intra molekuler merupakan ikatan antara atom H dan atom F,O,N yang terjadi di dalam sebuah molekul, misalnya ikatan antara atom H dan atom O pada senyawa H2O. Sementara untuk ikatan hidrogen ekstra molekuler adalah ikatan hidrogen yang terjadi antar senyawa, misalnya antara molekul H2O yang satu dengan molekul H2O lainnya.
3. Ikatan Kovalen

Ketika pertukaran elektron valensi terjadi antara atom-atom, ikatan kovalen terbentuk. Sebuah ikatan kovalen polar terbentuk ketika dua atom tidak berbagi elektron valensi sama.
Dalam ikatan kovalen atom berbagi elektron. Mari kita ambil contoh air. Sebuah molekul air H2O, yaitu terdiri dari dua atom hidrogen dan satu atom oksigen. Sebuah molekul air terbentuk ketika sebuah atom oksigen dan atom hidrogen menyumbangkan satu elektron untuk membentuk ikatan kimia. Jenis ikatan ini dikenal sebagai ikatan kovalen tunggal.
Dalam ikatan kovalen ganda, dua elektron valensi dibagi. Misalnya, oksigen di udara tidak muncul sebagai atom tunggal. Dua atom oksigen berbagi 2 elektron valensi masing-masing untuk membentuk O2.
4. Ikatan Logam 
Ikatan logam merupakan ikatan kimia yang terjadi karena adanya gaya tarik-menarik yang kuat antara ion positif dari logam terhadap elektron-elektron valensi yang bergerak bebas. Ikatan logam tersebut menyebabkan sifat-sifat logam diantaranya adalah pada suhu kamar rata-rata berwujud padat terkecuali logam Hg, keras namun dapat ditempa, menjadi konduktor atau penghantar panas yang baik, memiliki titik didih dan titik leleh yang tinggi serta wujud fisiknya yang mengkilap.
- Faktor Geometri yang menentukan ikatan kimia :
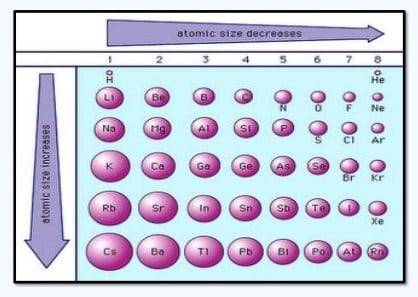
- Jari-jari atomik

Jari-jari atom yaitu jarak dari inti atom ke orbital elektron yang paling luar yang stabil pada suatu atom dalam keadaan setimbang. Biasanya jarak itu diukur kedalam satuan pikometer atau angstrom. hal itu karna elektron-elektron senantiasa bergerak, maka untuk mengukur jarak dari inti atom kepadanya begitu sulit. Namun, secara eksperimen mungkin untuk menentukan jarak antar inti atom. Jari-jari atomik yang ditentukan secara eksperimen merupakan salah satu parameter atomik yang sangat penting untuk mendeskripsikan kimia struktural senyawa.
2. Jari-jari Ionik

Karena kation dan anion unsur yang berbeda dalam senyawa ion diikat dengan interaksi elektrostatik, jarak ikatan adalah jumlah jari-jari ionik yang diberikan untuk kation dan anion.
Jari-jari ionik standar satu spesies ditetapkan terlebih dahulu dan kemudian dikurangkan dari jarak antar ion untuk menentukan jari-jari ion partnernya. Sebagai standar, jari-jari ion O2- dalam sejumlah oksida ditetapkan sebesar 140 pm (1 pm = 10-12 m).
3. Entalpi KisiWalaupun kestabilan kristal dalam suhu dan tekanan tetap bergantung pada perubahan energi bebas Gibbs pembentukan kristal dari ion-ion penyusunnya, kestabilan suatu kristal ditentukan sebagian besar oleh perubahan entalpinya saja. Hal ini disebabkan oleh sangat eksotermnya pembentukan kisi, dan suku entropinya sangat kecil (lihat bagian 3.1). Entalpi kisi, ∆HL, didefinisikan sebagai perubahan entalpi standar reaksi dekomposisi kristal ionik menjadi ion-ion gasnya (s adalah solid, g adalah gas and L adalah kisi (lattice)).
MX(s) → M+(g) + X- (g) ∆HL
Entalpi kisi secara tidak langsung dihitung dari nilai perubahan entalpi dalam tiap tahap menggunakan siklus Born-Haber (Gambar 2.1). Yakni, suatu siklus yang dibentuk dengan menggunakan data entalpi; entalpi pembentukan standar kristal ion dari unsur-unsurnya, ∆Hf, entalpi sublimasi padatan elementernya, entalpi atomisasi yang berhubungan dengan entalpi disosiasi molekul elementer gasnya, ∆Hatom, entalpi ionisasi yakni jumlah entalpi ionisasi pembentukan kation dan entalpi penangkapan elektron dalam pembentukan anion, ∆Ηion. 4. Tetapan Madelung

Energi potensial Coulomb total antar ion dalam senyawa ionik yang terdiri atas ion A dan B adalah penjumlahan energi potensial Coulomb interaksi ion individual, Vab. Karena lokasi ion-ion dalam kisi kristal ditentukan oleh tipe struktur, potensial Coulomb total antar ion dihitung dengan menentukan jarak antar ion d. A adalah tetapan Madelung yang khas untuk tiap struktur kristal. NA adalah tetapan Avogadro dan zA dan zB adalah muatan listrik kation dan anion. Interaksi elektrostatik antara ion-ion yang bersentuhan merupakan yang terkuat, dan tetapan Madelung biasanya menjadi lebih besar bila bilangan koordinasinya meningkat. Sebab muatan listrik mempunyai tanda yang berlawanan, potensialnya menjadi negatif, menunjukkan penstabilan yang menyertai pembentukan kisi kristal dari ion-ion fasa gas yang terdispersi baik. Walaupun potensial listrik terendah biasanya menghasilkan struktur paling stabil, namun ini tidak selalu benar sebab ada interaksi lain yang harus dipertimbangkan. Faktor terbesar selanjutnya yang berkontribusi pada entalpi kisi adalah gaya van der Waals, dan gaya dispersi atau interaksi London. Interaksi ini bersifat tarikan antara dipol listrik, yang berbanding terbalik dengan pangkat 6 jarak antar ion. Gaya van der Waals nilainya sangat kecil.
Struktur Kristal Logam
Ketika logam membeku dari bentuk cair ke padat, atom mengatur dirinya dalam baris – baris yang rapi, sebuah susunan yang disebut space lattice. Space lattice dari kristal telah dapat ditentukan untuk logam-logam yang berbeda.
Logam membeku membentuk 6 struktur lattice yang utama:
- Body Centered Cubic (BCC)
- Face Centered Cubic (FCC)
- Hexagonal Close Packed (HCP)
- Cubic
- Body Centered Tetragonal (BCT)
- Rhombohedral
Namun yang sering ditemui adalah jenis BCC,FCC, dan HCP.
- Body Centered Cubic (BCC)

Unit struktur BCC sesuai namanya berbentuk bentuk kubus dimana terdapat atom-atom disetiap pojoknya dan satu berada ditengah. Pada temperatur dibawah 1333OF (723OC) struktur kristal besi berupa BCC dan dinamakan besi alpha atau ferrite. Logam lain yang mempunyai struktur seperti ini, yaitu : chromium, colombium, barium, vanadium, molybdenum dan tungsten.
- Face Centered Cubic (FCC)

Atom-atom kalsium, aluminium, tembaga, timbal, nickel, emas dan platina membentuk suatu struktur kristal dengan sebuah atom ditiap-tiap pojok kubus dan satu ditengah disetiap sisi kubus. Jika besi berada diatas temperatur kritis, maka susunan atomnya berbentuk FCC dan namakan besi gamma atau austenite.
- Hexagonal Closed Packed (HCP)

Struktur HCP banyak ditemukan pada kebanyakan logam seperti berilium, seng, kobalt, titanium, magnesium, dan cadmium. Karena jarak dari struktur lattice, baris-baris atom tidak dapat bergerak dengan mudah, sehingga logam ini memiliki plastisitas dan keuletan yang lebih rendah dari struktur kubik.
Kristal Ionik

Kristal ionik terbentuk karena adanya gaya tarik antara ion bermuatan positif dan negatif. Umumnya, kristal ionik memiliki titik leleh tinggi dan hantaran listrik yang rendah. Contoh dari kristal ionik adalah NaCl. Kristal ionik tidak memiliki arah khusus seperti kristal kovalen sehingga pada kristal NaCl misalnya, ion natrium akan berinteraksi dengan semua ion klorida dengan intensitas interaksi yang beragam dan ion klorida akan berinteraksi dengan seluruh ion natriumnya.
Variasi Ungkapan Struktur Padatan
Banyak padatan anorganik memiliki struktur 3-dimensi yang rumit. Ilustrasi yang berbeda dari senyawa yang sama akan membantu kita memahami struktur tersebut. Dalam hal senyawa anorganik yang rumit, menggambarkan ikatan antar atom, seperti yang digunakan dalam senyawa organik biasanya menyebabkan kebingungan. Anion dalam kebanyakan oksida, sulfida atau halida logam membentuk tetrahedral atau oktahedral di sekeliling kation logam. Walaupun tidak terdapat ikatan antar anion, strukturnya akan disederhanakan bila struktur diilustrasikan dengan polihedra anion yang menggunakan bersama sudut, sisi atau muka. Dalam ilustrasi semacam ini,atom logam biasanya diabaikan.
Seperti telah disebutkan struktur ionik dapat dianggap sebagai susunan terjejal anion. Gambar 2.12 dan 2-13 mengilustrasikan ketiga representasi ini untuk fosfor pentoksida molekular P2O5 (= P4O10) dan molibdenum pentakhlorida MoCl5 (= Mo2Cl10). Representasi polihedra jauh lebih mudah dipahami untuk struktur molekul besar atau padatan yang dibentuk oleh tak hingga banyaknya atom. Namun, representasi garis ikatan juga cocok untuk senyawa molekular.
Faktor Elektron
Ikatan dan struktur senyawa ditentukan oleh sifat elektronik seperti kekuatan atom-atom penyusun dalam menarik dan menolak elektron. Orbital molekul yang diisi elektron valensi,
susunan grometrisnya dipenaruhi oleh interaksi elektronik antar elektron non ikatan.
1. Muatan Inti Negatif
Muatan inti efektif atau muatan nuklir efektif (sering dilambangkan sebagai atau ) adalah muatan positif bersih yang dialami oleh sebuah elektron dalam atom polielektronik. Digunakan istilah "efektif" karena efek pemerisaian elektron bermuatan negatif mencegah elektron pada orbital yang lebih tinggi dipengaruhi oleh muatan inti atom karena efek tolakan elektron dalam lapisan. Muatan inti efektif yang dialami oleh elektron pada kulit terluar juga disebut sebagai muatan pokok. Kekuatan muatan inti memungkinkan untuk ditentukan melalui bilangan oksidasi atom.
Persamaan : Zeff = Z – σ

2. Energi Ionisasi
Energi ionisasi (IE) adalah energi yang diperlukan untuk mengeluarkan elektron dari tiap mol spesies dalam keadaan gas.
A(g) → A+ (g) + e (g)
Energi ionisasi (Ei) diungkapkan dalam satuan elektron volt (eV)
= 96.49 kJmol-1
Dengan batasan tersebut berarti bahwa energi ionisasi bergantung pada seberapa kuat elektron terikat oleh atomnya atau seberapa kuat muatan inti efektif Zef berpengaruh terhadap elektron terluar yang akan dikeluarkan. Dengan demikian, energi ionisasi bervariasi seiring dengan bervariasinya gaya tarik elektrostatik Coulomb, yaitu mempunyai harga terendah untuk Zef terkecil dan r (jari-jari atom) terbesar.

3. Afinitas Elektron
Afinitas Elektron (electron affinity) yaitu negatif dari perubahan energi yang terjadi ketika satu elektron diterima oleh atom suatu unsur dalam keadaan gas. Afinitas elektron juga dinyatakan dalam kJ mol–1. Unsur yang memiliki afinitas elektron bertanda negatif, berarti mempunyai kecenderungan lebih besar dalam menyerap elektron daripada unsur yang afinitas elektronnya bertanda positif. Makin negatif nilai afinitas elektron, maka makin besar kecenderungan unsur tersebut dalam menyerap elektron (kecenderungan membentuk ion negatif).
Keelektronegatifan
Elektronegativitas atau keelektronegatifan (Simbol: χ) adalah sebuah sifat kimia yang menjelaskan kemampuan sebuah atom (atau lebih jarangnya sebuah gugus fungsi) untuk menarik elektron (atau rapatan elektron) menuju dirinya sendiri pada ikatan kovalen.
1. L. Pauling
Metode yang umumnya sering digunakan adalah metode Pauling. Hasil perhitungan ini menghasilkan nilai yang tidak berdimensi dan biasanya dirujuk sebagai skala Pauling dengan skala relatif yang berkisar dari 0,7 sampai dengan 4,0 (hidrogen = 2,2). Bila metode perhitungan lainnya digunakan, terdapat sebuah konvensi (walaupun tidak diharuskan) untuk menggunakan rentang skala yang sama dengan skala Pauling: hal ini dikenal sebagai elektronegativitas dalam satuan Pauling.

2. A. L. Allred dan E. G. Rochow
A. Louis Allred dan Eugene G. Rochow menganggap bahwa elektronegativitas harus terkait dengan muatan yang dialami oleh elektron pada "permukaan" atom: Semakin tinggi muatan per satuan luas permukaan atom, semakin besar kecenderungan itu. atom untuk menarik elektron. Muatan nuklir efektif , Z eff , yang dialami oleh elektron valensi dapat diperkirakan menggunakan aturan slater , sedangkan luas permukaan atom dalam molekul dapat dianggap sebanding dengan kuadrat dari jari-jari kovalen , r cov . Saat r cov diekspresikan dalam picometres.
Mulliken mengajukan bahwa purata aritmetik dari energi ionisasi pertama dan afinitas elektron haruslah yaitu sebuah perhitungan dari kecenderungan sebuah atom menarik elektron-elektron. Karena ruang lingkup ini tidak bergantung pada skala relatif sembarang, dia juga dinamakan sbg elektronegativitas relatif, dengan satuan kilojoule per mol atau elektronvolt.
Namun kebanyakan kita memakai transformasi linear untuk menerapkan transformasi nilai absolut tersebut menjadi nilai yang semakin mirip dengan nilai Pauling. Untuk energi inonisasi dan afinitas elektron dalam elektronvolt,
dan untuk energi dalam kilojoule per mol
Elektronegativitas Mulliken hanya dapat dihitung pada unsur-unsur yang afinitas elektronnya telah dikenal. Sampai dengan tahun 2006, terdapat 57 unsur yang afinitas elektronnya telah dikenal.

Energi Ionisasi adalah energi eksitasi dari HOMO dan afinitas elektron adalah energi penambahan elektron ke LUMO.Sehingga ke-elektronegatifan adalah rata-arat energi HOMO dan LUMO.
Molekul Orbital
Fungsi gelombang elektron dalam suatu atom disebut orbital atom. Karena kebolehjadian menemukan elektron dalam orbital molekul sebanding dengan kuadrat fungsi gelombang dan peta elektron nampak seperti fungsi gelombang
Suatu gelombang fungsi mempunyai daerah beramplitudo positif dan negatif yang disebut cuping (lobes).
Syarat pembentukan orbital :
1) Cuping orbital atom penyusunannya cocok untuk tumpang tindih
2) Tanda positif atau negatif cuping yang bertumpang tindih sama
3) Tingkat energi orbital-orbital atomnya dekat


REFERENSI :




Baguss
BalasHapusBaguss Kak
BalasHapusBagus kakk, sangat bermanfaat👍👍👍
BalasHapusBagus kakak
BalasHapusMantep👍
BalasHapusBagus kk
BalasHapusSangat bermanfaat
BalasHapusniceee
BalasHapusGoood
BalasHapus👍👍👍
BalasHapus⭐⭐⭐⭐⭐
BalasHapusmantul
BalasHapusKeren kk
BalasHapusNice
BalasHapusBagus👍
BalasHapusBaguss👌
BalasHapusGoood 👍
BalasHapusniceee
BalasHapus