RANGKUMAN KONFIGURASI ELEKTRON
KONFIGURASI ELEKTRON
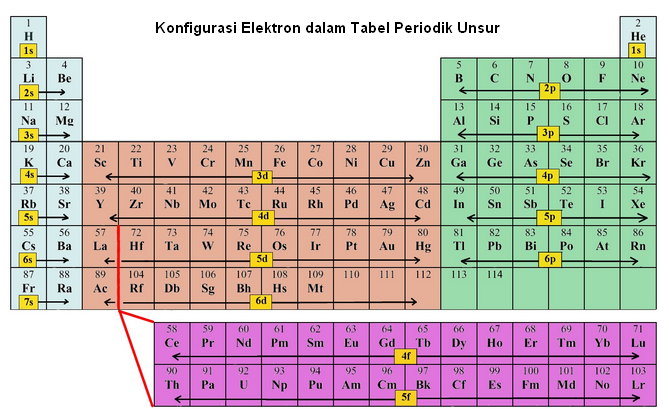
➤Dalam menentukan konfigurasi elektron suatu atom, ada 3 aturan yang harus dipakai, yaitu : Aturan Aufbau, Aturan Pauli, dan Aturan Hund.

 1. Konfigurasi elektron adalah susunan elektron-elektron pada sebuah atom, molekul, atau struktur fisik lainnya.Contohnya :
1. Konfigurasi elektron adalah susunan elektron-elektron pada sebuah atom, molekul, atau struktur fisik lainnya.Contohnya :
- Li mempunyai 3 elektron maka konfigurasinya adalah
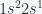
- Konfigurasi elektron dari
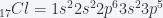
Konfigurasi elektron yang pertama kali diusulkan adalah model atom Bohr.
Yang harus diingat juga bahwa :
- Orbital s diisi 2 elektron
- Orbital p diisi 6 elektron
- Orbital d diisi 10 elektron
- Orbital f diisi 14 elektron
* Bilangan Kuantum (dalam fungsi gelombang) adalah bilangan yang memiliki makna khusus dalam menjelaskan keadaan sistem kuantum. Bilangan-bilangan kuantum dapat memberikan deskripsi keadaan elektron dalam atom. Setiap orbital atom memiliki satu set tiga bilangan kuantum yang unik, antara lain bilangan kuantum utama (n), azimuth (atau momentum angular) (l), dan magnetik (ml).
1. Bilangan kuantum utama (n) mendeskripsikan ukuran dan tingkat energi orbital. Semakin besar nilai n, maka semakin besar ukuran orbital dan semakin tinggi tingkat energinya. Nilai n yang diperbolehkan adalah bilangan bulat positif (1, 2, 3, dan seterusnya).
2. Bilangan kuantum azimut sering disebut bilangan kuantum anguler (sudut). Energi sebuah elektron berhubungan dengan gerakan orbital yang digambarkan dengan momentum sudut. Momentum sudut tersebut dikarakterisasi menggunakan bilangan kuantum azimut. Bilangan azimut menyatakan bentuk suatu orbital dengan simbol "huruf L kecil". Bilangan kuantum azimut juga berhubungan dengan jumlah subkelopak. Nilai ini menggambarkan subkelopak yang dimana elektron berbeda. Untuk subkelopak s, p, d, f bilangan kuantum azimut berturut-turut adalah 0,1,2,3.
3. Bilangan kuantum magnetik atau disebut juga dengan sistem orbital atom dapat disimbolkan dengan (m).
- l= 0, subkulit s punya 1 obital ; m = 0
- l = 1, subkulit p punya 3 orbital ; m = -1, m = 0, m = 1
- l = 2, subkulit d punya 5 orbital ; m = -2, m = -1, m = 0, m = 1, m = 2
- l = 3, subkulit f punya 7 orbital ; m = -3, m = -2, m = -1, m = 0, m = 1, m = 2, m =3
➤Adapula Bilangan Kuantum Spin yaitu, bilangan kuantum yang menentukan momentum sudut intrinsik (momentum sudut spin) partikel tertentu. Ia dilambangkan dengan huruf s; dan menggambarkan energi, bentuk dan orientasi orbital.
1. Aturan Aufbau
Aufbau adalah kata benda bahasa Jerman yang berarti "konstruksi". Prinsip Aufbau kadang-kadang disebut prinsip membangun atau aturan Aufbau. Menurut prinsip Aufbau ini elektron di dalam suatu atom akan berada dalam kondisi yang stabil bila mempunyai energi yang rendah, sedangkan elektron-elektron akan berada pada orbital-orbital yang bergabung membentuk subkulit. Jadi, elektron mempunyai kecenderungan akan menempati subkulit yang tingkat energinya rendah. Jadi orbital s akan lebih dulu diisi dari orbital p.


2. Asas Larangan Pauli
Asas larangan Pauli adalah prinsip mekanika kuantum yang dirumuskan oleh fisikawan Austria Wolfgang Pauli pada tahun 1925. Dalam bentuk yang paling sederhana untuk elektron pada atom tunggal, aturan ini menyatakan bahwa tidak ada dua elektron yang memiliki bilangan kuantum yang sama. Jadi bila n, l, dan ml kedua elektron semuanya sama, ms haruslah berbeda, sehingga kedua elektron tersebut memiliki spin berlawanan. Secara lebih umum, tidak ada dua fermion identik (partikel dengan spin pecahan) boleh menduduki keadaan kuantum yang sama secara bersamaan.

3. Aturan Hund
Frederick Hund, 1927 (dikenal Hund) menyatakan bahwa elektron yang mengisi subkulit dengan jumlah orbital lebih dari satu akan tersebar pada orbital yang mempunyai kesamaan energi (equal-energy orbital) dengan arah putaran (spin) yang sama.
Asas ini dikemukakan berdasarkan penalaran bahwa energi tolak-menolak antara dua elektron akan minimum jika jarak antara elektron berjauhan.

4. Aturan Setengah Penuh
Sifat ini berhubungan erat dengan hibridisasi elektron. Aturan ini menyatakan bahwa : “suatu elektron mempunyai kecenderungan untuk berpindah orbital apabila dapat membentuk susunan elektron yang lebih stabil.....untuk konfigurasi elektron yang berakhiran pada sub kulit d berlaku aturan penuh setengah penuh. Untuk lebih memahamkan teori ini perhatikan juga contoh di bawah ini :
dari contoh terlihat apabila 4s diisi 2 elektron maka 3d kurang satu elektron untuk menjadi setengah penuh....maka elektron dari 4s akan berpindah ke 3d. hal ini juga berlaku untuk kasus :
Referensi :
https://id.wikipedia.org/wiki/Konfigurasi_elektron
https://id.wikipedia.org/wiki/Bilangan_kuantum
http://suryanhaya.blogspot.com/
Frederick Hund, 1927 (dikenal Hund) menyatakan bahwa elektron yang mengisi subkulit dengan jumlah orbital lebih dari satu akan tersebar pada orbital yang mempunyai kesamaan energi (equal-energy orbital) dengan arah putaran (spin) yang sama.
Asas ini dikemukakan berdasarkan penalaran bahwa energi tolak-menolak antara dua elektron akan minimum jika jarak antara elektron berjauhan.

4. Aturan Setengah Penuh
Sifat ini berhubungan erat dengan hibridisasi elektron. Aturan ini menyatakan bahwa : “suatu elektron mempunyai kecenderungan untuk berpindah orbital apabila dapat membentuk susunan elektron yang lebih stabil.....untuk konfigurasi elektron yang berakhiran pada sub kulit d berlaku aturan penuh setengah penuh. Untuk lebih memahamkan teori ini perhatikan juga contoh di bawah ini :
24Cr = 1s2 2s2 2p6 3s2 3p6 4s2 3d4 menjadi 24Cr = 1s2 2s2 2p6 3s2 3p6 4s1 3d5
dari contoh terlihat apabila 4s diisi 2 elektron maka 3d kurang satu elektron untuk menjadi setengah penuh....maka elektron dari 4s akan berpindah ke 3d. hal ini juga berlaku untuk kasus :
29Cu = 1s2 2s2 2p6 3s2 3p6 4s2 3d9 menjadi 29Cu = 1s2 2s2 2p6 3s2 3p6 4s1 3d10
https://id.wikipedia.org/wiki/Konfigurasi_elektron
https://id.wikipedia.org/wiki/Bilangan_kuantum
http://suryanhaya.blogspot.com/



Sangat membantu
BalasHapusWahhh,,,terimakash kakak,,pembahsnny mudh dipahami
BalasHapusniceee
BalasHapus👍👍👍
BalasHapusKeren
BalasHapusGood vinka🐣🐣
BalasHapusbagus dan sangat bermanfaat
BalasHapusSangat bermanfaat👍
BalasHapusBermanfaat
BalasHapusMantap
BalasHapusBagus blognya, sangat bermanfaat👍
BalasHapusmantappp
BalasHapusThe best
BalasHapus